La bufala della ranitidina cancerogena e le fake news sui farmaci ritirati
di neXtQuotidiano
Pubblicato il 2019-09-26
L’AIFA segnala che sui social network si stanno diffondendo liste di farmaci che nulla hanno a che vedere con la ranitidina. Alcune precisazioni sulla bufala della ranitidina cancerogena e su Buscopan e Zantac

L’Agenzia italiana del farmaco (Aifa) informa che “nelle ultime ore sui social network si stanno diffondendo liste di farmaci che nulla hanno a che vedere con quelli oggetto dei provvedimenti restrittivi disposti nei giorni scorsi che riguardano esclusivamente farmaci contenenti ranitidina“. Lo precisa l’Aifa in una nota. “Aifa – si legge – raccomanda di consultare esclusivamente le informazioni pubblicate sul portale dell’Agenzia. Gli elenchi dei lotti dei farmaci contenenti ranitidina interessati dal ritiro e di quelli interessati dal divieto di utilizzo sono disponibili alla pagina www.aifa.gov.it/revisione-ranitidina. Ogni altro elenco difforme da quelli indicati non è da considerarsi attendibile”.
La bufala della ranitidina cancerogena e le fake news sui farmaci
Sull’allarme comparso nelle testate nazionali circa il ritiro di farmaci contenenti ranitidina, interviene in una nota Giuseppe Milazzo, Presidente Nazionale Aigo, Associazione Italiana Gastroenterologi. “Occorre fare chiarezza- afferma il presidente di Aigo- ed evitare allarmi ingiustificati. Va innanzitutto ricordato che la ranitidina è un farmaco che dovrebbe essere utilizzato solo per pochi giorni o qualche settimana in quanto perde efficacia con l’utilizzo continuo per un fenomeno di ‘tolleranza’. Nel caso specifico, in una fabbrica indiana è stato utilizzato tra gli eccipienti della ranitidina una sostanza cancerogena. Si tratta, quindi, di un problema legato alla produzione in uno specifico stabilimento e non di tossicità della molecola ranitidina. Per cautela, l’Aifa ha disposto il ritiro di tutte le confezioni di ranitidina, anche quelle prodotte in maniera corretta“.
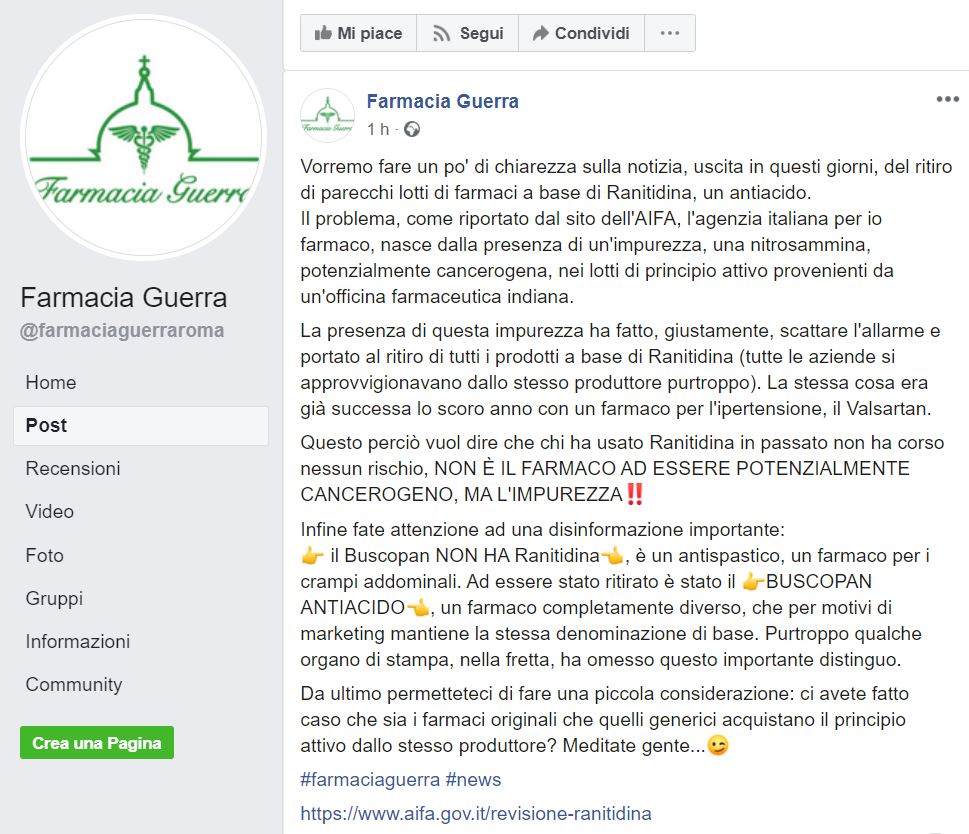
Anche alcune farmacie si sono impegnate a spiegare il significato dello stop dell’AIFA:
Il problema, come riportato dal sito dell’AIFA, l’agenzia italiana per io farmaco, nasce dalla presenza di un’impurezza, una nitrosammina, potenzialmente cancerogena, nei lotti di principio attivo provenienti da un’officina farmaceutica indiana.
La presenza di questa impurezza ha fatto, giustamente, scattare l’allarme e portato al ritiro di tutti i prodotti a base di Ranitidina (tutte le aziende si approvvigionavano dallo stesso produttore purtroppo). La stessa cosa era già successa lo scoro anno con un farmaco per l’ipertensione, il Valsartan.
Questo perciò vuol dire che chi ha usato Ranitidina in passato non ha corso nessun rischio, NON È IL FARMACO AD ESSERE POTENZIALMENTE CANCEROGENO, MA L’IMPUREZZA
E hanno spiegato anche la situazione relativa al Buscopan:
Il Buscopan NON HA Ranitidina, è un antispastico, un farmaco per i crampi addominali. Ad essere stato ritirato è stato il BUSCOPAN ANTIACIDO, un farmaco completamente diverso, che per motivi di marketing mantiene la stessa denominazione di base. Purtroppo qualche organo di stampa, nella fretta, ha omesso questo importante distinguo.
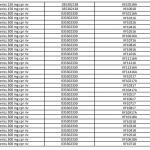
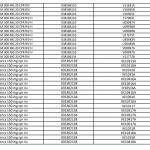
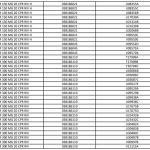
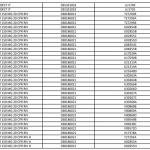
Ranitidina: l’elenco dei farmaci ritirati aggiornato al 23 settembre
Lo scorso 20 settembre è stata diffusa una prima lista di lotti di farmaci con il principio attivo ranitidina prodotto dall’officina SARACA LABORATORIES LTD in India, ritirati in quanto contenti la N-nitrosodimetilammina (Ndma). Con il nuovo aggiornamento, passano da 195 a oltre 515 i lotti di farmaci ritirati in via precauzionale, in attesa di accertamenti: tra questi 13 lotti di Buscopan antiacido da 75 mg in compresse effervescenti con scadenza il primo maggio 2021. Nella lunga lista si trovano inoltre 34 lotti di Zantac tra compresse, fiale e sciroppo. E, ancora, tra gli altri, 22 lotti di Ranibloc, diversi lotti di Raniben, Ranidil, Ulcex, ranitidina Zentiva, ranitidina Hexa. Nell’elenco aggiornato al 23 settembre 2019 sono presenti Zantac Compresse da 150 e da 300 mg e fiale 5 ML oltre alle compresse effervescenti oltre alla ranitidina Aurobindo.
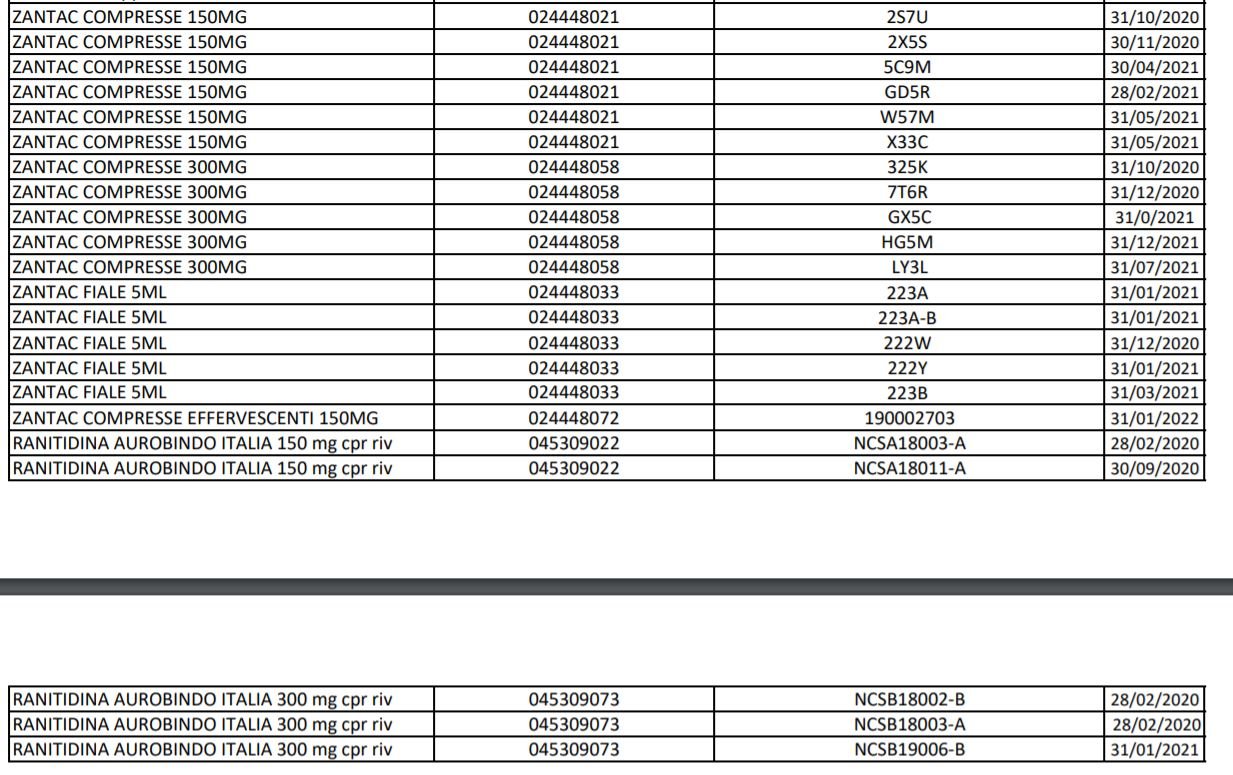
Questo è l’elenco completo aggiornato al 23 settembre, disponibile anche sul sito dell’AIFA:
La Ranitidina trova impiego per il trattamento del reflusso gastroesofageo, dell’ulcera, e della sindrome di Zollinger-Ellison, o di altre affezioni in cui lo stomaco secerne una quantità molto elevata di acidi. Inoltre può essere impiegata per trattare le emorragie del primo tratto dell’apparato digerente e prevenire alcuni tipi di ulcera, per i bruciori di stomaco associati, per esempio, all’acidità di stomaco, e per i danni allo stomaco provocati o dall’inalazione degli acidi gastrici durante l’anestesia, o dall’assunzione di FANS. Si tratta infatti di un farmaco H2 antagonista che agisce riducendo la quantita’ di acido prodotto dallo stomaco. Tra i farmaci ritirati, il cui elenco completo è reperibile sul sito dell’Agenzia del farmaco a questo indirizzo, anche il Ranitidina Ratiopharm da 150 e da 300 mg, il Ranitidina Mylan Generics da 150 e da 300 mg, lo Zantac sia in compresse da 150 o 300 mg sia in fiale da 5 ml, il Ranitidina Aurobindo da 150 e da 300 mg.
EDIT: Intanto l’Agenzia europea per i medicinali, Ema, ha chiesto alle aziende di riesaminare, per precauzione, tutti i farmaci per la possibile presenza di nitrosammine e di testare tutti i prodotti a rischio. Nel caso in cui venissero rilevate nitrosammine, l’Ema raccomanda alle aziende di informare tempestivamente le autorita’ “affinche’ possano essere intraprese adeguate azioni normative”. Le nitrosammine sono classificate come probabili agenti cancerogeni per l’uomo, il che significa che un’esposizione a lungo termine al di sopra di determinati livelli può aumentare il rischio di cancro. La loro presenza è il motivo per cui l’Aifa ha ritirato diversi prodotti a base di ranitidina. “Nel frattempo, la CHMP (Committee for Medicinal Products for Human Use) continuerà a valutare le conoscenze scientifiche disponibili sulla presenza di nitrosammine nei medicinali e consiglierà le autorità preposte alla regolamentazione sulle azioni da intraprendere nel caso in cui le aziende trovassero nitrosammine nei loro medicinali”, scrive l’Ema.
Leggi anche: Eutanasia, cosa cambia dopo la sentenza della Consulta sul suicidio assistito